Термодинамика и кинетическая теория газов затрагивали самые глубокие вопросы мировоззрения. Единство сил природы, направленность естественных процессов, неизменность «кирпичей мироздания» —все эти вопросы так или иначе возникали из новых теорий и представлений. Рушилась концепция мира, разделенного непе-реходимыми перегородками на отдельные области. Одним из последних устоев этой концепции было представление о совершенных, «постоянных» газах, не переходящих ни в жидкое, ни в твердое состояние и поэтому существенно отличающихся от паров жидкостей.
«Есть ли разница между паром и газом?» — спрашивал А. Г. Столетов в своем «Очерке развития наших сведений о газах» (1879), подходя к вопросу о сжижении газов. Столетов излагает историю развития учения о парах, формирования представлений о ненасыщенных парах, не отличающихся в своем поведении от газов, и насыщенных парах, которые не подчиняются закону Бойля — Мариотта, и, наконец, историю сжижения газов. Эта история начинается с опытов Каньяра де Латура (1777-1859), проведенных в 1822 г. Нагревая жидкости (воду, эфир, алкоголь) в запаянных трубках, он заметил, что при некоторой температуре, различной для разных жидкостей, вещество в трубке становится однородным, представляя собой густой пар. Для эфира это происходило при температуре 200°С, для спирта —около 260°С, для воды — около 360°С. Таким образом инженер-географ, а потом чиновник министерства внутренних дел Каньяр де Латур еще в первой четверти XIX в. установил, что при определенных условиях граница между жидкостью и ее газом исчезает.
Через год молодой ассистент Дэви М. фарадей получил жидкий хлор, затем, нагревая один конец изогнутой стеклянной трубки с газом и охлаждая другой конец, обратил в жидкость девять газов, а в 1844—1845 гг. еще шесть. При этом фарадей сделал очень важный вывод из опытов Каньяра де Латура, указав, что существует температура, при которой «нельзя ожидать, что какое-либо повышение давления, исключая, быть может, чересчур сильное, могло обратить газ в жидкость».
В 1861 г. существование такой температуры было установлено Д. И. Менделеевым. Он назвал ее абсолютной температурой кипения. «Чтобы истинное значение такой температуры, — писал Менделеев в первом томе своих «Основ химии», —выступило явственно, следует обратить внимание на то, что жидкое состояние характеризуется сцеплением частиц, отсутствующим в газах и парах. Сцепление жидкостей выражается в капиллярных явлениях... и произведение из плотности жидкости на высоту ее поднятия в капиллярной трубке (определенного диаметра) может служить мерою величины сцепления... Сцепление жидкостей уменьшается при их нагревании, поэтому уменьшаются и капиллярные высоты. Опыт показывает, что это уменьшение (почти) пропорционально температуре, а потому из капиллярных наблюдений получается, что при некоторой возвышенной температуре сцепление становится равным нулю. Если в жидкости исчезает сцепление частиц — она становится газом, ибо между этими двумя состояниями нет, кроме сцепления, иного коренного различия. Преодолевая его, жидкости при испарении поглощают теплоту. Поэтому температура абсолютного кипения определена мною (1861) как таковая, при которой: а) жидкость не существует и дает газ, не переходящий в жидкость, несмотря на увеличение давления; b) сцепление = 0 и с) скрытая теплота испарения = 0».
Наблюдения Каньяра де Латура, выводы фарадея и Менделеева не получили резонанса. «Понятия эти, — писал Менделеев, — мало распространились, пока Эндрюс (Andrews, 1869) не выяснил дела с другой стороны, именно исходя из газов. Он нашел, что углекислый газ при температурах выше 31°С не сгущается ни при каких давлениях, при низких же температурах может сжижаться. Температуру эту он назвал критической. Очевидно, что она тождественна с температурой абсолютного кипения ».
Томас Эндрюс родился 19 декабря 1813 г. в Белфасте. Он изучал химию в университете в Глазго. Уже вскоре после поступления в университет он в своей домашней лаборатории выполнил две химические работы. Для совершенствования своих химических познаний он едет в Париж, где работает в лаборатории Дюма и одновременно в госпитале с целью изучения медицины. Возвратившись на родину, он продолжает образование в Дублинском колледже св. Троицы и в Ирландской медицинской школе. В 22 года он получает степень доктора медицины в Эдинбурге, а затем профессора химии в родном городе Белфасте в Королевском колледже. В 1845 г. он становится вице-президентом колледжа и занимает эту должность до выхода в отставку в 1879 г. Умер Эндрюс 26 ноября 1885 г.
Основополагающая статья Эндрюса «О непрерывности газообразного и жидкого состояний вещества» была прочитана в Лондонском Королевском обществе 17 июня 1869 г. и опубликована в 159-мтоме «Philosophical Transactions of fhe Royal Society» за 1869 г. Эндрюс начинает ее с истории вопроса, с опытов Каньяра де Латура, исследований фарадея, Реньо, Пулье, Натерера, подвергавших газы сжатию до 2790 атмосфер.( 1 атмосфера (1 ат) равна 9,8 • 100000 Па. ) Он указывает на свою заметку 1861 г., в которой описывает попытку обратить в жидкость кислород, водород, азот, окись углерода и окись азота, подвергая их большим давлениям и одновременно охлаждению в ванне из углекислоты и эфира. Опыты дали отрицательный результат. Далее он приводит выдержку из своего письма Миллеру, опубликованную в «Химической физике» в 1863 г.: «При частичном снижении углекислоты посредством одного только давления и при постепенном повышении в то самое время температуры до 88° Фаренгейта (31,1°С. — П.К.) поверхность раздела между жидкостью и газом делается менее резкой, теряет свою кривизну и, наконец, исчезает. В это время пространство заполнено однородным текучим веществом, в котором в случае внезапного уменьшения давления или небольшого понижения температуры обнаруживается характерное явление полос, перебегающих или волнующихся по всей его массе. При температуре выше 88° нельзя получить никакого видимого снижения углекислоты или разделения ее на две отличные друг от друга формы вещества, даже если прилагать давления в 300 или 400 атмосфер. Окись азота дала сходные результаты».
В статье 1869 г. Эндрюс подробно описывает аппаратуру, примениющуюся при исследованиях. Изменяя температуру углекислого газа от 13 до 48°С, он получил изотермы, имевшие при температурах ниже 31,1°С характерный излом, показывающий сжижение газа и переход кривой в прямую, параллельную оси абсцисс, при полном обращении газа в жидкость. При температуре 31,1°С, которая была на 0,2° выше температуры, названной им критической, никакого разделения газа на две части не наблюдается «и самое тщательное исследование не может открыть никакой однородности в состоянии углекислоты внутри трубки».
При дальнейшем повышении температуры изотермы непрерывно приближаются к той изотерме, «которая представляет изменение объема совершенного газа». Изменяя давление и температуру, Эндрюс добивался непрерывного перехода вещества «из состояния, которое всеми рассматривается как газообразное, в то, которое подобным же образом обычно рассматривают как жидкое...» «Дело начинается с газа и через ряд постепенных изменений, нигде не представляющих какого-нибудь резкого изменения объема или внезапного развития тепла, кончается жидкостью». Эндрюс ставит важный вопрос, что происходит с углекислотой в критическом состоянии: «Продолжает ли она оставаться в газообразном состоянии, или она превратилась в жидкость, или мы имеем дело с новым состоянием материи?» Эндрюс считает, что ответ на этот вопрос «надо найти в близких внутренних соотношениях, которые существуют между газообразными и жидкими состояниями вещества». Жидкость и газ являются различными формами одного и того же вещества, и от одной формы к другой можно перейти непрерывным изменением. Отсюда началась длительная дискуссия о природе критического состояния. Эндрюс считал, что называть ли вещество в этом состоянии жидкостью или газом — дело вкуса. Важно, что это особое переходное состояние.
Скажем несколько слов об экспериментальной технике Эндрюса. Сжатие газа производилось с помощью винта, давление при этом достигало 4 • 107 Па. Эндрюс работал с газами, имеющими высокую критическую температуру, и проблема получения низких температур перед ним не стояла. Основная цель его исследования заключалась не в проблеме сжижения газов, а в доказательстве отсутствия резкого различия между паром и газом, в доказательстве возможности непрерывного перехода от газа к жидкости. Энгельс отмечал результат Эндрюса как важный момент в переходе от метафизического к диалектическому мировоззрению. В предисловии к «Анти-Дюрингу» он писал: «Прежние неизменные противоположности и резкие, непереходимые разграничительные линии все более и более исчезают. С тех пор, как было достигнуто сжижение последних «истинных» газов, как было установлено, что тело может быть приведено в такое состояние, в котором капельножидкая и газообразная формы неразличимы,— агрегатные состояния потеряли последний остаток своего прежнего абсолютного характера».(Энгельс ф. Анти-Дюринг. - Маркс К., Энгельс ф. Соч., 2-е изд., т. 20, С. 13. )
Непрерывность жидкого и газообразного состояний была теоретически исследована в диссертации Ван-дер-Ваальса (1837—1923), опубликованной в 1873 г. Эта диссертация вышла вторым изданием в 1899 г., составив первую часть монографии «Непрерывность газообразного и жидкого состояний». Вторая часть этой монографии, посвященная бинарным смесям, вышла в 1900 г. В 1910 г. Ван-дер-Ваальсу «за его труды, относящиеся к уравнению состояния газов и жидкостей», была присуждена Нобелевская премия по физике. В предисловии к своей диссертации 1873 г. Ван-дер-Ваальс писал: «Название «Непрерывность газообразного и жидкого состояний», кажется вполне подходящим, поскольку в основу рассуждений положена главная мысль, что от одного агрегатного состояния можно совершенно непрерывным образом достигнуть другого; выражаясь геометрически, это значит, что обе части изотермы принадлежат одной кривой, даже тогда, когда эти части связаны частью, которая не может быть осуществлена в действительности». «Строго говоря, — продолжает Ван-дер-Ваальс, — я хочу доказать еще больше, а именно тождественность обоих агрегатных состояний». Ван-дер-Ваальс считает, что между жидкостью и газом существует только количественное различие в большей или меньшей плотности, но не качественное.
Уравнение Ван-дер-Ваальса и его изотермы вошли во все учебники физики, и на их рассмотрении мы останавливаться не будем.
Работа Эндрюса получила широкий резонанс, и критическое состояние стало предметом исследования физиков многих стран. Существенный вклад в изучение критического состояния внесли русские физики А.Г.Столетов (1839-1896), Б. Б. Голицын (1862-1916), М.П.Авенариус (1835-1895). А.Г.Столетов в ряде статей (1882, 1892, 1893, 1894) рассмотрел и разъяснил вопросы, относящиеся к критическому состоянию, высказал существенные замечания по некоторым утверждениям. Он изучил обширную литературу по теме, начиная с работ Эндрюса и Ван-дер-Ваальса. Он отмечает, что с теоретической стороны идея Эндрюса (Столетов пишет «Андрюс») разработана Ван-дер-Ваальсом, Клаузиусом и Максвеллом, а с экспериментальной «прежде всего и более всего трудами М.П.Авенариуса и его учеников (Зайончевского, Надеждина, Страуса)». Ученик Ленца М.П.Авенариус, продолжая традиции своего учителя, в 70-х годах организует физическую лабораторию в Киевском университете. В лаборатории Авенариуса по существу впервые в России был поставлен физический практикум и студентами велись научные исследования. Несмотря на то что, как говорил Авенариус, «помещение лаборатории мизерно до невозможности», здесь под руководством Авенариуса проделан ряд превосходных работ по физике критического состояния. Результаты исследований Авенариуса и его учеников по определению критических постоянных различных веществ вошли в мировую справочную литературу.
Вопрос о критическом состоянии тесно связан с проблемой сжижения газов. Газ никаким давлением не может быть обращен в жидкость, если он не охлажден до температуры ниже критической. Существуют различные методы сжижения газов. Адиабатический метод основан на охлаждении газа при адиабатическом расширении. Этим методом Кальете обратил в декабре 1877 г. в жидкость кислород. Кислород, сжатый в трубке до давления 3000 атмосфер и охлажденный с помощью соответствующей смеси до — 29°С, внезапно расширялся, давление падало до 1 атмосферы, температура понижалась до — 200°С.
Швейцарский физик Рауль Пикте (1846-1929) добился почти одновременно с Кальете сжижения кислорода, получив кислород в виде жидкости, а не тумана, как у Кальете. Пикте применял последовательное, или каскадное, охлаждение.

Немецкий физик Карл Линде (1842— 1934), применив дроссельный эффект, или эффект Джоуля — Томсона, открытый этими учеными в 1852 г., построил машину для получения жидкого воздуха с производительностью несколько литров в час. Этот принцип позволил в 1898 г. Дьюару (1842—1923) ожижить водород, что тщетно пытались сделать Пикте, Вроблевский, Ольшевский (1846—1915). Последние наблюдали на мгновение туман из капель водорода, но получить ощутимую порцию жидкости им не удавалось. Вроблевский (1845— 1888) погиб от взрыва при опыте по сжижению водорода.
Еще труднее оказалось обратить в жидкость гелий— Х. Камерлинг-Оннес (1853—1926) смог осуществить сжижение гелия только спустя 10 лет после сжижения водорода. Первая порция жидкого гелия была получена им 10 июля 1908 г. У гелия очень низкая температура инверсии (—240°С), а дроссельное охлаждение начинается только при температуре ниже температуры инверсии. Поэтому гелий приходится предварительно охлаждать жидким водородом, а потом уже пропускать через дроссель. Этот метод оказывается очень сложным и малоэффективным, и в течение длительного времени лишь лейденская лаборатория Камерлинга-Оннеса производила жидкий гелий. В 30-х годах XX в. появились новые эффективные установки, в частности известный турбодетандер П.Л.Капицы.
Переходим теперь к теоретическим достижениям. Здесь прежде всего необходимо указать на интенсивное развитие термодинамики, которая из механической теории теплоты превратилась в мощную теоретическую дисциплину, применимую не только к механическим и тепловым, но и к другим областям физики и химии. Этой мощью термодинамика обязана общности своих понятий и методов, приложимых к любой конкретной физической системе независимо от ее структуры и состояния . Так, уже Карно нашел и успешно применил метод циклов к исследованию тепловых машин и получил результат, не зависящий от конкретного устройства машины. Метод циклов позволил Клаузиусу получить результаты термодинамики весьма общего характера.
В дальнейшем развитии термодинамики метод циклов широко использовался, изобретались различные циклы, позволяющие получить надежные выводы о том или ином физическом или химическом процессе. Наряду с методом циклов развился и аналитический метод— метод термодинамических функций. Термодинамические функции—это функции состояния системы, обладающие тем свойством, что при переходе системы от одного состояния в другое их изменение не зависит от пути перехода и дифференциал таких функций есть полный дифференциал. Такой функцией является потенциальная энергия в механике. Но еще до установления закона сохранения энергии петербургский академик Герман Иванович Гесс (1802—1850), изучая теплоту, выделяемую или поглощаемую при химических реакциях, нашел, что, «каким бы путем ни совершалось соединение—имело ли место оно непосредственно или происходило косвенным путем в несколько приемов,— количество выделившейся при его образовании теплоты всегда постоянно». Этот принцип Гесс нашел еще в 1836 г. Он обосновал его далее экспериментально и в 1840 г. сформулировал в виде положения: «Когда образуется какое-либо химическое соединение, то при этом всегда выделяется одно и то же количество тепла, независимо от того, происходит ли образование этого соединения непосредственно или же косвенным путем».

Этот термохимический закон Гесса может быть выражен аналитически, если ввести функцию состояния — энтальпию, или тепловую функцию Количество теплоты не является функцией состояния, количество теплоты, выделяемое или поглощаемое при физическом процессе, зависит от характера процесса. Но химическая реакция наблюдается в условиях постоянного давления, и в этом случае, действительно, количество теплоты не зависит от характера перехода и выражается разностью значений энтальпии.
Однако энтальпия была введена в термодинамику значительно позже 1840 г. Термодинамические функции — внутренняя энергия и энтропия — были введены Клаузиусом. В 1869 г. Массье (1832—1896) прибавил к этим функциям две новые, которые он назвал характеристическими. Если обозначить внутреннюю энергию через V, энтропию через S, абсолютную температуру через Т, объем через V, а давление через р, то функции Массье имеют вид:
(-U+TS)/T и (-U+TS-pV)/T.
Массье показал, что из функции такого вида могут быть выведены термодинамические свойства жидкости. Дальнейший шаг был сделан американским физиком Гиббсом.
Джозайя Вилард Гиббс родился 11 февраля 1839 г. в Нью-Гевене, штат Коннектикут, в семье профессора Гейльского университета. В 1866 г. он уехал на три года в Европу, был в Париже, учился в Берлине у Магнуса, в Гейдельберге у Кирхгофа и Гельмгольца и в 1869 г. вернулся в Нью-Гевен, где в 1871 г. получил звание профессора математической физики Иельского университета

Первые работы Гиббса, начиная с его докторской диссертации, были посвящены технической механике. Став профессором, он читал механику, волновую оптику, векторный анализ, теорию электричества и магнетизма. В 1873 г. появились его первые термодинамические работы «Графические методы в термодинамике жидкостей» и «Метод геометрического представления термодинамических свойств веществ при помощи поверхностей».
В первой из этих работ Гиббс развил графический метод, впервые примененный Клапейроном в теории цикла Кар-но. Клапейрон представлял процессы цикла графически в системе осей: объем — давление. Гиббс ввел диаграммы в переменных: энтропия и температура, энтропия и объем, логарифмы объема, температуры и давления. Цикл Карно в системе энтропия — температура изображался, как отмечал сам Гиббс, «чрезвычайно простой фигурой — четырехугольником, в котором стороны параллельны осям координат». Распространение графического метода на термодинамику очень ценил Максвелл, отмечая, что Гиббсу «мы обязаны тщательным исследованием различных методов представления термодинамических соотношений с помощью плоских диаграмм». Особенно восхищался Максвелл второй работой Гиббса, в которой Гиббс «предложил чрезвычайно плодотворный метод, а именно исследование свойств любого вещества при помощи поверхности». Эту термодинамическую поверхность, как ее называл Гиббс, он строил в системе осей, в которой прямоугольные координаты различных точек поверхности были равны объему, энтропии и энергии тела в его различных состояниях. Максвелл собственноручно изготовил гипсовую термодинамическую поверхность воды и послал ее Гиббсу.
Заметим, что термодинамическая поверхность воды, по Гиббсу и Ван-дер-Ваальсу, стала предметом кандидатского сочинения молодого русского физика Д. А. Гольдгаммера, которое он закончил в 1882 г. Оно было опубликовано в «Ученых записках» Московского университета в 1885 г.
В этой же работе Гиббс формулирует условие устойчивого равновесий термодинамической системы в виде1 минимального значения функции U-TS+pV (у Гиббса: е-Гр+рУ), которую мы теперь называем термодинамическим потенциалом Гиббса. В большом исследовании «О равновесии гетерогенных систем», публиковавшемся в 1875—1878 гг., Гиббс развил и широко применил метод термодинамических функций. Указав, что такие термодинамические функции, как энергия и энтропия, значительно облегчают понимание законов, управляемых любой термодинамической системой, Гиббс отмечает, что «разные значения энергии и энтропии в целом характеризуют то, что существенно в действиях, производимых системой при переходе от одного состояния к другому». Он пишет далее, что функция, выражающая способность системы совершать механическую работу, «играет ведущую роль в теории равновесия». Именно здесь Гиббс, комбинируя такие функции состояния, как энтропию, которую он обозначает н),
и энергию, которую он обозначает ε, вводит дит функцию:
Ψ= ε-tη
(в современных обозначениях F = U - TS),
χ=ε+рV
(в современных обозначениях Н = U + PV),
ζ=ε-tη + pV
(в современных обозначениях Φ = U - TS + pV).
Первую из этих функций переоткрыл Гельмгольц в 1882 г., назвал ее «свободной энергией» и с ее помощью построил термодинамическую теорию гальванического элемента.
Вторая функция получила название энтальпии или тепловой функции. С ее помощью описывается процесс Джоуля — Томсона. Последняя функция называется термодинамическим потенциалом Гиббса.
В своем исследовании Гиббс сформулировал условия равновесия гомогенной и гетерогенной системы, состоящей из произвольного числа компонентов и фаз. Термин «фаза» введен Гиббсом, под ним он понимает тела, характеризуемые состоянием и составом, причем «мы считаем все тела отличающимися друг от друга только количеством и формой, разными образцами одной и той же фазы».
Рассматривая условия равновесия гетерогенной системы, Гиббс находит правило фаз, согласно которому система, состоящая из r фаз и п независимых компонентов, «способна к n+2 - r измерениям фаз», или, как принято говорить теперь, имеет f = n+2-r степеней свободы.
Вскоре после окончания своего классического исследования, весной 1879 г. Гиббс был избран членом Национальной Академии США, в 1880 г. — членом Американской Академии наук и искусств в Бостоне. В благодарственном письме в Бостонскую Академию Гиббс, между прочим, писал: «Ведущей идеей моей работы «Равновесие гетерогенных систем» было выявление роли энергии и энтропии в теории термодинамического равновесия. При их помощи легко выразить общее условие равновесия, а приложение его к различным случаям приводит нас сразу к специальным условиям, характеризующим эти случаи».
Научная слава Гиббса быстро росла после опубликования его термодинамических работ. Он избирается членом многих зарубежных академий и научных обществ, получает научные награды. В 1902 г. вышел фундаментальный труд Гиббса «Основы статистической механики». 28 апреля 1903 г. Гиббс скончался.
После Гиббса термодинамика перестала быть только механической теорией теплоты она превратилась в весьма общую теоретическую систему, прило-жимую ко всем физическим и химическим процессам. Гельмгольц, применивший в 1882 г. свободную энергию к теории гальванического элемента, писал в статье «К термодинамике химических процессов»: «Наиболее исчерпывающим и общим способом термодинамические условия для молекулярных и химических процессов в системах тел, состоящих или смешанных из произвольного числа простых веществ, были развиты аналитически г-ном Д. В. Гиббсом (1878)».
М.Планк применил в 1888 г. метод Гиббса к теории разведенных растворов. Читая лекции по теоретической физике в Колумбийском университете в Нью-Йорке 24 апреля 1909 г., он говорил: «Как глубоко охватывает это предложение (принцип возрастания энтропии) все физические и химические отношения, на это лучше и полнее других было указано Джоном Вилардом Гиббсом, одним их наиболее знаменитых теоретиков всех времен не только Америки, но и всего мира».
Всеобъемлемость принципов термодинамики, в частности второго начала, заставляла физиков-теоретиков искать причины такой универсальной мощи термодинамики. В результате в науке возникли два направления: феноменологическое и атомистическое, феноменологическое направление не считало необходимым искать более глубоких причин физических процессов, оно ограничивало задачу изучения природы описанием явлений на основе экспериментально установленных принципов. Успехи термодинамики привели к появлению энергетического направления в науке. Энергетики Гельм, Оствальд и другие считали энергию основным понятием науки, а такие понятия, как «материя», «сила», производными и даже излишними.
Что касается представления об атомах и молекулах, то энергетики, а также венский физик Эрнст Мах, один из видных сторонников феноменологического направления, считали эти представления продуктами чистой фантазии, аналогичными представлениям о ведьмах и привидениях. Раскрывать понятия и законы термодинамики с помощью молекулярно-кинетической теории они считали антинаучным занятием.
Однако такие видные представители науки, как Клаузиус, Максвелл, а затем Больцман, с успехом разрабатывали мо-лекулярно-кинетическую теорию. Идея молекулярного движения, происходящего по законам механики, вместе с тем подсказывала мысль: обосновать термодинамику законами механики. Осуществлению этой мысли посвятили усилия Клаузиус, Гельмгольц, Больцман и др. Здесь с самого начала возникала трудность объяснения второго начала и необратимых процессов, поскольку уравнения механики обратимы. Попытка истолковать второе начало с помощью вариационного принципа Гамильтона не принесла ощутимых результатов. Но Больцману удалось получить фундаментальный результат и заложить основы статистической механики.
Людвиг Больцман родился 20 февраля 1844 г. в Вене. Учился он в университетах Вены, Гейдельберга и Берлина. Еще студентом он публикует в Вене работы: «О движении электричества в кривых поверхностях» (1865) и «О механическом истолковании второго начала теории тепла» (1866). Этой второй работой начался длительный цикл работ Больцмана по выяснению связи между термодинамикой и механикой. Цель своей работы он формулирует так: «Дать чисто аналитическое, совершенно общее доказательство второго начала теории тепла и отыскать соответствующий ему принцип механики».

В 1867г. Больцман кончает университет и публикует работу «О числе атомов в молекуле газа и внутренней работе в газе». В 1868 г. он издает большую работу «Исследование равновесия живых сил движущихся материальных точек» и другие статьи. Талант крупного теоретика настолько ясно выразился в этих ранних работах Больцмана, что в следующем, 1869 г. двадцатипятилетний Больцман избирается профессором физики в Граце. Отметим, что в Граце Больцман руководил кафедрой экспериментальной физики, на которой была уже создана прекрасная физическая лаборатория, оборудованная всем необходимым как для научных исследований, так и для студенческого практикума. Он занимает здесь кафедру до 1873 г., затем возвращается в Вену, чтобы занять здесь кафедру математики. В Вене Больцман пробыл всего три года и в 1876 г. вновь возвращается в Грац, где остается до 1889 г. В этот период он выполняет свои важнейшие работы по статистической физике. С 1889 по 1894 г. Больцман — профессор в Мюнхене, с 1894 по 1900 г. Больцман опять в Вене, откуда уезжает на два года (1900—1902) в Лейпциг. В 1902 г. Больцман возвращается в Вену, где живет до своей смерти, последовавшей 16 сентября 1906 г.
Фундаментальным вкладом Больц-мана в физику является создание статистической механики и статистического обоснования второго начала. Уже в ранней работе «Исследование равновесия живых сил движущихся материальных точек» Больцман ставит задачу «найти общую теорему для вероятности распределения положений и скоростей таких движущихся материальных точек». Для случая частиц, находящихся в сильном поле, потенциальная энергия которого зависит от координаты х и равна f(x), Больцман находит, что «вероятность того, что х находится между х и х + dx..., пропорциональна
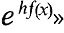
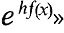
Таким образом, Больцман уже в возрасте двадцати четырех лет нашел закон распределения, носящий теперь его имя. Больцман, основываясь на работе Максвелла, обобщил его закон распределения, рассматривая газ в силовом поле. Дальнейшее обобщение Больцман сделал в работе «О тепловом равновесии многоатомных молекул газа». «Для случая, когда каждая молекула является одной материальной точкой, — писал Больцман, — Максвелл определил вероятность различных состояний». Больцман выписывает закон Максвелла в виде:
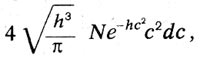
где N - число молекул в единице объема, с - скорость молекул, h - константа, определяемая температурой. «Но встречающиеся в природе молекулы, — писал Больцман, — отнюдь не являются простыми материальными точками. Мы, очевидно, будем ближе к действительности, если будем рассматривать их как систему нескольких материальных точек (так называемых атомов), которые удерживаются вместе определенными силами. Тогда состояние молекулы в определенный момент времени будет определяться не одной переменной, а многими». Максвелл в 1875 г. в статье «О динамическом доказательстве молекулярного строения тел» присоединяется к результатам Больцмана. Он писал: «Опубликованные мной в 1860 г. результаты подверглись затем более строгому исследованию доктора Людвига Больцмана, применившего также свой метод к изучению движения сложных молекул». Указав на трудности теории теплоемкости, Максвелл считает, что теорема Больцмана дает возможность объяснить закон Дальтона, выравнивание температур в вертикальном столбе газа и «открывает, по-видимому, путь в чисто химическую область исследования».
Критические замечания Максвелла о кинетической теории теплоемкости также примыкают к рассуждениям Больцмана. Больцман показал, что средняя кинетическая энергия всех атомов, которые считаются точками, одна и та же и равна 3/2h. Отсюда для двухатомных молекул отношение теплоемкостей Ср /Сv должно равняться 1,33, а опыт дает для воздуха 1,41. Больцман считает это расхождение обусловленным взаимодействием молекул с эфиром. Максвеллу это объяснение кажется сомнительным.
В 1876 г. Больцман уточнил свою теорию теплоемкости. В статье «О природе газовых молекул» он указал на про тиворечие своей теории с опытом и сослался на обобщение его теоремы, сделанное Максвеллом и Уатсоном. Максвелл и Уатсон понимали молекулу как систему, положение которой определяется т переменными величинами, не зависящими от движения молекул. Это число т называется числом степеней свободы. Для одноатомной молекулы число степеней свободы равно 3 и отношение теплоёмкостей равно 1и2/3. Для двухатомных молекул число степеней свободы равно пяти: «три координаты центра тяжести и две переменных, определяющих направление центральной линии молекулы». Поэтому для них оно будет λ`/λ=1,4. Если молекулу представлять как твердое тело с шестью степенями свободы, то λ`/λ =1,33.
Теорема Больцмана о равномерном распределении кинетической энергии по степеням свободы молекулы, лежащая в основе классической теории теплоемкости, является важным результатом статистики Больцмана. Однако важнейшим результатом многолетних исследований Больцмана по кинетической теории газов было открытие им связи между энтропией и вероятностью. Упорные поиски механического обоснования второго начала термодинамики увенчались успехом. Но это обоснование потребовало введения понятия вероятности и было достигнуто на путях развития статистической механики.
Формулировка, развитие и защита «теоремы— Н», которая выражает связь между энтропией и вероятностью данного состояния системы, составили дело жизни Больцмана. Оно началось с его юношеской работы 1866 г. и продолжалось до последней статьи «Кинетическая теория материи», написанной is сотрудничестве с Ноблем для «Математической энциклопедии». Статья была закончена в октябре 1905 г., и выпуск «Энциклопедии», в котором она была опубликована, был снабжен кратким сообщением «Памяти Людвига Больцмана», начинавшимся словами: «В этом выпуске на первом месте помещена статья Больцмана о кинетической теории материи и вместе с тем это последнее создание его рук».
Основная работа, в которой Больцман впервые формулирует свою теорему, — это работа 1872 г. «Дальнейшее исследование теплового равновесия газовых молекул». Здесь Больцман со всей четкостью утверждает, что «проблемы механической теории теплоты являются проблемами статистическими». Больцман выводит основное уравнение для функции распределения f и показывает, что существует такая функция Е, зависящая от логарифма f, которая всегда убывает и лишь при достижении статистического равновесия остается постоянной. В этом состоянии равновесия функция распределения совпадает с максвелло-больцмановским распределением.
В статье 1877 г. «О связи второго начала механической теории теплоты с исчислением вероятностей» Больцман подробно развивает свой статистический метод. Он указывает в самом начале статьи, что связь между вторым началом термодинамики и исчислением вероятностей «обнаруживается прежде всего в том, что, как мною было показано, аналитическое доказательство второго начала невозможно никакими другими способами, кроме тех, которые заимствуются из теории вероятностей». Чрезвычайно интересно с исторической точки зрения введение Больцманом в этой работе гипотезы, что молекула газа может терять и приобретать только дискретные порции энергии, кратные некоторой наименьшей порции энергии ε. «Перед столкновением, — пишет Больцман, — каждая из обеих сталкивающихся молекул имеет живую силу 0, или ε, или 2ε и т. д. ... или pε и вследствие какой-то причины будет происходить то, что и после соударения никогда ни одна из сталкивающихся молекул не принимает живой силы, не содержащейся в этом ряде». Так Больцман начинает свои статистические рассуждения, оговариваясь, однако, что это фикция, которой не соответствует ничего реального, но которая облегчает математическую трактовку проблемы. В дальнейших вычислениях Больцман освобождается от гипотезы, полагая в пределе эпсилон ε=0.
Больцман ставит задачу найти закон распределения, который позволяет знать, как много из общего числа молекул n обладает энергией 0, ε, 2ε,.... Он подсчитывает, сколько комбинаций соответствует такому распределению состояний, полагая, что число этих комбинаций определяет вероятность данного состояния.
Если бы Больцман считал молекулы газа неразличимыми, как это делал в квантовой теории идеального газа Эйнштейн, и сохранил предположение о конечной порции энергии, то он получил бы формулу статистики Бозе—Эйнштейна. Но Больцман этого не сделал. Он считал неразличимыми между собой молекулы, находящиеся в одном и том же энергетическом состоянии. Однако когда молекула одной энергетической группы меняется местами с молекулой другой энергетической группы, то, хотя распределение молекул не меняется, тем не менее возникает новая комплексия. Число комплексий, которым может быть осуществлено данное состояние, и определяет, по Болыдману, вероятность этого состояния. Таким образом, она, по Больцману, определяется числом:
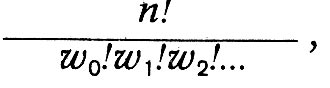
где n - общее число молекул, w0 - число молекул, обладающих энергией, равной нулю (Больцман считает энергию между 0 и ε, отступая от первоначальной квантовой гипотезы), w1, — число молекул, обладающих энергией ε (между ε и 2ε), и т. д. При этом
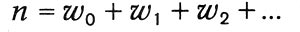
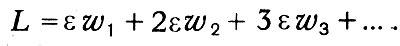
Логарифмируя выражение для вероятности и определяя максимум этой логарифмической функции при условии постоянства n и L, Больцман находит распределение Максвелла — Больцмана, которое оказывается, таким образом, наиболее вероятным распределением. Подсчитывая наиболее вероятное распределение скоростей, Больцман вводит величину Θ, равную среднему логарифму функции распределения, взятой со знаком минус. Максимальное значение этой величины, которую Больцман называет «мерой распределения», при условии постоянства числа молекул и их общей кинетической энергии определяет наиболее вероятное распределение.
Величину, которую Больцман обозначал через Е и Θ, в дальнейшем стали обозначать Н, и она оказалась пропорциональной энтропии. Закон возрастания энтропии у Больцмана получает простую интерпретацию: «Система стремится к наиболее вероятному состоянию». Второе начало потеряло характер абсолютного закона природы и стало статистическим законом. В природе возможны процессы, происходящие в направлении убывания энтропии, и это, по мнению Больцмана, избавляет Вселенную от тепловой смерти. Для космоса в целом тепловой смерти нет. Взгляды и выводы Больцмана подвергались ожесточенной критике. Но вместе с тем они воспринимались и развивались другими исследователями: Максвеллом, Лоренцем, Планком. Планк дал простой вывод и простое точное выражение соотношения между энтропией и вероятностью. В обозначениях Планка оно имеет вид:
S = k lnW,
где S - энтропия, W - вероятность, k -постоянная, равная R/N, которую Планк назвал в честь Больцмана постоянной Больцмана. Из соотношения Планка исчезла неопределенная аддитивная константа, фигурирующая у Больцмана, и это соответствует тепловой теореме Нернста. формула соотношения между энтропией и вероятностью, данная Планком, фигурирует сегодня во всех руководства и монографиях как соотношение Больцмана.
В 1912 г., читая лекции по статистическим теориям термодинамики в Париже, Лоренц говорил об успехах кинетической теории газов. Он указывал, как бы подводя итоги многолетней борьбы сторонников феноменологического описания с приверженцами атомистики: «Теперь нельзя сомневаться в их существовании после того, как «реальность молекул» стала фактом, почти что «наблюдаемым» непосредственно; молекулы существуют для нас совершенно так Же, как и многие другие предметы, непосредственно нами не видимые, но в существовании которых наш ум вовсе не сомневается». Далее Лоренц продолжал: «Основываясь на этих блестящих результатах, можно поставить вопрос: нельзя ли найти закон Карно — Клаузиуса при помощи молекулярных теорий, понимая, конечно, последние в очень широком смысле, так как общности результата должна каким-либо образом соответствовать общность предпосылок? Австрийскому физику Больцману принадлежит честь первого успешного подхода к этой задаче и установление связи между понятием вероятности, определенным образом понимаемой, и термодинамическими функциями, в частности энтропией. Рядом с ним нужно считать одним из основателей этой новой ветви теоретической физики — статистической термодинамики — Уилларда Гиббса. Далее следует упомянуть работы Пуанкаре, Планка и Эйнштейна. Общий результат, который можно считать окончательно установленным, это существование связи между энтропией некоторого состояния и вероятностью этого состояния». К именам, упомянутым Лоренцем, следует добавить имена П.Эренфеста и Т. А. Афанасьевой-Эренфест, которым принадлежит ряд работ по статистической термодинамике, и в частности фундаментальная обзорная статья о принципиальных основах статистического понимания, опубликованная в «Математической энциклопедии» в 1911 г.
Все эти работы относятся к более позднему времени. Больцман же мог прочитать и оценить лишь книгу Гиббса «Основные принципы статистической механики», вышедшую в 1902 г. Он пришел также к пониманию идей Планка, как об этом писал сам Планк в своей автобиографии. Но все это происходило уже в XX в., когда физика переходила на новые пути, переживая мучительный кризис старого, «классического» понимания природы.
В период жизни Больцмана был один физик, разрабатывавший проблемы, которыми занимался и Больцман, и внимательно следивший за его работами. Это был сын знаменитого русского хирурга Н.И.Пирогова Н. Н. Пирогов (1843—1891). В ряде работ, публиковавшихся в Журнале русского физико-химического общества за 1885-1890 гг., Пирогов рассматривал проблемы кинетической теории газов и статистической термодинамики. В них он не только защитил результаты Болыдмана, но и уточнил и развил и-х, сформулировав ряд важных идей, найденных статистической физикой позже. К сожалению, работы Пирогова, публиковавшиеся на русском языке, остались малоизвестными и не оказали своевременного влияния на развитие статистической термодинамики. Советские историки физики «открыли» Н. Н. Пирогова лишь в конце сороковых годов XX в..( См.: Спасский Б. И. Н. Н Пирогов.—В кн.: Развитие физики в России.— М.: Просвещение, 1970, с. 300-308. )

Остановимся в заключение на развитии представлений о самом атоме. Максвелл, Клаузиус, Больцман, Гиббс, развивая физическую атомистику, искали законы, управляющие поведением коллектива атомов и молекул, делая по возможности простые гипотезы о строении самих атомов. В XIX в. единственным средством наблюдать взаимодействия атомов и определять их индивидуальные особенности были химические реакции. Именно в недрах химической атомистики родилась первая гипотеза о строении всех атомов из атомов водорода (Проут, 1815). Химия выработала учение об элементе, определила атомные веса различных атомов, установила характерные особенности различных элементов.
В 1859 г. было сделано важное открытие в оптике, физик Густав Кирхгоф (1824—1887) и химик Роберт Бунзен (1811—1899) открыли спектральный анализ, давший в руки химикам новое мощное средство исследования. Отметим, что это открытие было сделано в Гейдельбергской физической лаборатории сначала с флинт-призмой, отшлифованной самим фраунгофером, а затем со спектральным аппаратом с четырьмя фраунгоферовыми призмами, сконструированными Кирхгофом совместно с Бунзеном. Сами Кирхгоф и Бунзен методом спектрального анализа обнаружили элементы цезий (1860) и рубидий (1861). В 1861 г Крукс открыл спектроскопическим путем таллий. Через два года Райх и Рихтер обнаружили индий.
Чрезвычайно интересна история открытия гелия. Кирхгофу впервые удалось раскрыть загадку фраунгоферовых линий и показать, что они получаются в результате поглощения лучей, испускаемых Солнцем, элементами, входящими в состав солнечной атмосферы. Так было доказано присутствие на Солнце ряда химических элементов. При наблюдении во время затмения соответствующие линии ярко вспыхивают в спектре Солнца. Наблюдая в 1868 г полное солнечное затмение, французский астроном Жан сен и английский астроном Локьер независимо друг от друга открыли в спектре Солнца яркую желтую линию, не принадлежащую ни одному из известных на Земле элементов. Локьер предположил, что эта линия испускается элементом, встречающимся только на Солнце, который он предложил поэтому назвать гелий (от греческого «гелиос» — Солнце) В 1895 г. английский химик Рамзей, исследуя спектроскопически газы, выделяющиеся при обработке кислотой минерала клевеита, нашел желтую линию гелия, который он в том же году выделил химически из газовой смеси.
В 1869 г. было известно 63 хими ческих элемента. В этом же году Д.И.Менделеев открыл фундаментальный закон распределения элементов в систему, которую он назвал периодической системой химических элементов.
Д.И.Менделеев родился 8 февраля 1834 г. в семье директора Тобольской гимназии. Д.И.Менделеев учился на физико-математическом факультете Петербургского педагогического института. Среди его учителей были известный математик М. В. Остро градский, физик Э.Х. Ленц, «отец русских химиков» А. А. Воскресенский. В этой обстановке научное дарование Менделеева развивалось быстро — и уже студентом он выполнил первую работу о химическом составе минералов ортита и пироксена. Институт он окончил с золотой медалью в 1855 г. и по состоянию здоровья вынужден был уехать в Крым, а затем в Одессу, где работал учителем гимназии. На юге здоровье Менделеева восстановилось, и в 1856 г. он вернулся в Петербург. Успешно сдав магистерские экзамены, он защитил диссертацию «Об удельных объемах». Затем он защитил диссертацию «О строении кремнеземистых соединений» на звание доцента Петербургского университета, в котором в 1857—1858 гг. читал курс теоретической и органической химии.
В январе 1859 г. Менделеев был командирован за границу. Там он работал в лабораториях Бунзена, Кирхгофа и Коппа, а также в организованной им домашней лаборатории, в которой выполнил свое исследование по абсолютной температуре кипения.
В 1860 г. Менделеев принял участие в съезде химиков в Карлсруэ, где Канниццаро, к которому примкнул и Менделеев, защищал теорию Авогадро — Жерара и новое определение атомных весов. С этого съезда химики стали правильно определять атомные веса элементов, что имело огромное значение для будущего великого открытия Менделеева.

После двухлетнего пребывания за границей Менделеев вернулся в Петербург и приступил к чтению курса органической химии в университете. В 1867 г. А.А.Воскресенский уехал в Харьков попечителем учебного округа, и Менделеев занял освободившуюся кафедру неорганической химии Петербургского университета. При подготовке к чтению лекций университетского курса химии Менделеев рассуждал о связи между химическими элементами и составил их картотеку, раскладывая карточки «наподобие пасьянса». Он обратил внимание на периодичность в расположении атомных весов и повторяемости свойств элементов. 17 февраля 1869 г. Д. И. Менделеев составил карточку «Опыт системы элементов», которую и разослал некоторым химикам. Сообщение Д.И.Менделеева Русскому химическому обществу «Соотношение химических свойств с атомным весом элементов» сделал 6 марта (ст. стиля) 1869 г. Н.А.Меншуткин. В этом сообщении Менделеев излагал историю вопроса и причины, побудившие его им заняться.
«Предприняв составление руководства к химии, названного «Основы химии», — писал Менделеев, — я должен был остановиться на какой-нибудь системе простых тел, чтобы в распределении их не руководствоваться случайными, как бы инстинктивными, побуждениями, а каким-либо точным началом».
Указав, что со времен Жерара и Канниццаро уж нет сомнения в значении атомных весов элементов, «как это было несколько лет тому назад, когда атомный вес столь часто смешивался с эквивалентом и определялся на основании разнородных часто противоположных начал», Менделеев пишет, что он «старался основать систему по величине атомного веса элементов». Приведя результаты предпринятых им проб, которые показали, что между естественными свойствами элементов и величиной атомного веса существует некоторое точное отношение, Менделеев заключает: «Все сличения, сделанные мною в этом направлении, приводят меня к тому заключению, что величина атомного веса определяет природу элемента настолько же, насколько вес частицы определяет свойства и многие реакции сложного тела. Если это убеждение подтвердится дальнейшим применением выставленного начала, то мы приблизимся к эпохе понимания существенного различия и причины сходства элементарных тел».
Далее Менделеев пишет: «Отныне, мне кажется, приобретается еще новый интерес в определении атомных весов, в открытии новых простых тел и в отыскании новых между ними аналогий».
Так, уже в первом наброске системы, которую сам Менделеев не считал «совершенно законченной», он ясно видел, что открытый им закон приближает эпоху «понимания существенного различия и причины сходства элементарных тел» и что он может служить путеводным началом в открытии новых, еще неизвестных элементов. Менделеев в этом сообщении со всей определенностью писал: «Должно ожидать открытия еще многих неизвестных простых тел, например сходных с А1 и Si элементов с паем 65—75».
В качестве первого вывода из своего исследования Менделеев записал: «Элементы, расположенные по величине их атомного веса, представляют явственную периодичность их свойств». Такова первая формулировка периодического закона, сыгравшего фундаментальную роль в истории атомной и ядерной физики.
Менделеев продолжал работать над развитием и укреплением своего закона. 3 декабря 1870 г. он выступил в заседании Русского химического общества с сообщением «Естественная система элементов и ее применение к указанию свойств некоторых элементов». Он предсказал существование экабора, открытого шведским химиком Ниль-соном в 1879 г., названного скандием, экаалюминия, открытого французским химиком Лекок де Буабодраном под названием талий в 1875 г., и экакремния, открытого в 1886 г. немецким химиком Винклером под названием германий.
Открытие периодического закона и предсказание на его основе новых элементов было высоко оценено Энгельсом, которьй назвал открытие Менделеева научным подвигом и сравнил его с предсказанием Леверье планеты Нептун. Это была очень высокая оценка— закон Менделеева оказался по своей точности и силе сравнимым с законами небесной механики. Эта оценка оправдалась и в дальнейшей истории закона: со времени его открытия было найдено свыше сорока новых элементов с самыми различными свойствами, и все они оказались включенными в систему Менделеева, а при открытии трансурановых элементов она служила руководящей нитью.
Американские ученые во главе с Сиборгом, открыв в 1955 г. элемент № 101, назвали его менделевий «в знак признания пионерской роли великого русского химика Дмитрия Менделеева, который первым использовал периодическую систему для предсказания химических свойств еще не открытых элементов — принцип, который послужил ключом для открытия последних, или трансурановых элементов».
Великий автор периодического закона отличался необычайной разносторонностью и широтой научной и общественной деятельности. Он был профессором Петербургского университета, в котором совместно с А. М. Бутлеровым и Н. А. Меншуткиным провел всю подготовительную работу по созданию новой химической лаборатории, которая была построена в 1891—1894 гг., когда А.И.Менделеева уже не было в университете. Он был вынужден уйти из университета в начале 1890 г. в знак протеста против действий министерства народного просвещения в связи со студенческими волнениями.
В 1893 г А И Менделеев был назначен хранителем Палаты мер и весов, которая под его руководством превратилась в первоклассное научно-метрологическое учреждение — Главную палату мер и весов, ныне Всесоюзный научно-исследовательский институт метрологии и стандартизации (ВНИИМС).
Д. И.Менделеева глубоко интересовало развитие промышленности и экономики России. Этому он посвятил немало трудов, активно участвуя в различных правительственных комиссиях, в том числе и по выработке таможенного тарифа. Нефтяное дело, металлургия, заводское дело, земледелие, промышленное развитие России, ее народонаселение—все интересовало ученого, везде он оставил свой неизгладимый след.
Кипучая, разносторонняя деятельность Дмитрия Ивановича Менделеева оборвалась в 1907 г. 20 января 1907 г. он скончался в Петербурге от воспаления легких.
С открытием спектрального анализа и периодического закона химических элементов стало ясно, что атом представляет сложную структуру с внутренними движениями его составных частей, порождающих характерные спектры. Но прежде чем приступить к изучению этой структуры, физике предстояло сделать новый шаг в развитии электромагнитной теории. Этот шаг был сделан Максвеллом.
|
|
© Historik.ru 2001-2018 При копировании материалов проекта обязательно ставить ссылку на страницу источник: http://historik.ru/ "Книги по истории" |